Gli ormoni fisiologicamente coinvolti nella regolazione del metabolismo fosfo-calcico sono classicamente tre: PTH (paratormone), CT (calcitonina) e 1,25OHD3 (1,25-di-idrossi-colecalciferolo o calcitriolo).
Ruolo del paratormone nella regolazione del metabolismo fosfo-calcico
Il PTH (peptide di 84 AA, con frammento N-terminale 1-34 biologicamente attivo), secreto dalle paratiroidi, agisce a livello osseo sugli osteoblasti stimolando la secrezione di RANKL (Receptor Activator of Nuclear Factor kappa-B Ligand) e inibendo la secrezione di OPG (osteoprotegerina) e quindi attivando il riassorbimento osseo da parte degli osteoclasti (RANKL interagisce con il recettore RANK presente sulla superficie dei pre-osteoclasti determinandone la maturazione, l’attivazione e la proliferazione in osteoclasti maturi).
A livello osseo, PHT stimola il riassorbimento di calcio e fosforo
Il PTH agisce inoltre a livello renale stimolando il riassorbimento tubulare di calcio e l’enzima 1-alfa-idrossilasi (responsabile dell’ attivazione della vitamina D cioè della trasformazione della 25OHD3 in 1,25OHD3 che rappresenta la forma biologicamente attiva) e inibendo il riassorbimento tubulare di fosfato (blocco del cotrasportatore sodio-fosforo IIa e IIc con conseguente effetto fosfaturico) (1).
A livello renale, PHT stimola il riassorbimento di calcio, attiva 1-alfa-idrossilasi (conversione di 25OHD3 in 1,25 OHD3) e inibisce il riassorbimento di fosfato
Azione della calcitonina nella regolazione del metabolismo fosfo-calcico
La calcitonina (polipeptide di 32 aminoacidi) ha un ruolo biologico non chiaro e poco influisce sui livelli di calcio. È secreta dalle cellule parafollicolari o cellule C o cellule chiare della tiroide, in base alle variazioni della calcemia sul CASR (Calcium Sensing Receptor). La sua azione ipocalcemizzante, di inibizione dell’attività osteoclastica e di antagonista del PTH, è importante in alcune specie animali (pesci e rettili), ma non nell’uomo in cuila scarsa attività biologica dell’ormone è testimoniata dal fatto che la tiroidectomia totale e il carcinoma midollare della tiroide non influenzano in modo significativo i livelli di calcemia (1).
La calcitonina ha un’azione poco rilevante sia a livello osseo sia a livello renale
Coinvolgimento del calcitriolo nella regolazione del metabolismo fosfo-calcico
La 1,25OHD3 (calcitriolo, forma biologicamente attiva della vitamina D con propri recettori nucleari) agisce principalmente a livello intestinale dove stimola l’assorbimento di calcio attraverso la sintesi di calbindina (una proteina intestinale con quattro siti di legame per il calcio), e di fosfato attraverso il cotrasportatore sodio-fosforo IIb.
L’azione più importante del calcitriolo è a livello intestinale, dove stimola l’assorbimento di calcio e fosforo
Sebbene siano stati dimostrati recettori per la vitamina D sugli osteoblasti, non è ancora del tutto definita un’azione diretta a livello scheletrico del calcitriolo: si è ipotizzata una regolazione positiva sull’osteoclastogenesi attraverso la stimolazione di RANK-L e l’inibizione della sintesi di osteoprotegerina, ma anche una azione sull’attività osteoblastica.
A livello scheletrico non è ancora definita un’azione diretta del calcitriolo
A livello renale stimola il riassorbimento tubulare di calcio e fosfato. Le azioni non classiche (extra-scheletriche) della vitamina D (attivazione della 1alfaidrossilasi PTH-indipendente) avvengono a livello: muscolare (promuovendo l’incremento del diametro e del numero delle fibre muscolari di tipo II), pancreatico (potenziando la secrezione insulinica e migliorando l’insulino-sensibilità) e delle cellule immuno-competenti -macrofagi e linfociti- (modulando la risposta immune a patogeni e a insulti ripetuti) (2,3).
Il calcitriolo stimola il riassorbimento di calcio e fosforo a livello renale
La Tabella 1 riassume le principali azioni degli ormoni PHT, calcitonina e calcitriolo
Tabella 1. Ormoni fisiologicamente coinvolti nella regolazione del metabolismo fosfo-calcico
| OSSO | RENE | INTESTINO | |
| PTH |
|
|
– |
| CT |
|
|
– |
| calcitriolo |
|
|
|
Ruolo di CASR nella regolazione della omeostasi calcica
Un ruolo centrale nella regolazione della omeostasi calcica ha il calcium sensing receptor (CASR), presente sulla membrana plasmatica di molte cellule dell’organismo, ove funge da “sensore” dei livelli plasmatici di calcio; in particolare il calcio presente nel sangue attraverso il CASR entra nella cellula paratiroidea esercitando un feed-back negativo sulla secrezione di PTH, nella cellula del tubulo renale (tratto ascendente dell’ansa di Henle) inibendo il riassorbimento tubulare del calcio e negli osteoclasti inibendone la differenziazione e l’attivazione. I polimorfismi del gene CaSR rendono ragione, in parte, della variabilità individuale nelle concentrazioni sieriche di calcio (1).
Asse FGF23-Klotho nella regolazione della omeostasi della fosforemia
Nella regolazione della omeostasi della fosforemia, negli ultimi anni sono state indagate nuove e complesse interazioni fra cellule dell’osso e mediatori del metabolismo fosfo-calcico, in particolare riveste sempre maggiore rilevanza clinica e scientifica l’asse FGF23-Klotho.
L’FGF23 (fibroblast growth factor 3) è una glicoproteina, appartenente alla classe delle fosfatonine, prodotta in sede intraossea dagli osteociti e dagli osteoblasti, la cui secrezione è stimolata da numerosi fattori esogeni ed endogeni: PTH, carico di fosforo alimentare, vitamina D attiva, deficit di Klotho, sistema renina-angiotensina-aldosterone, sideropenia, infiammazione e ipossia (4).
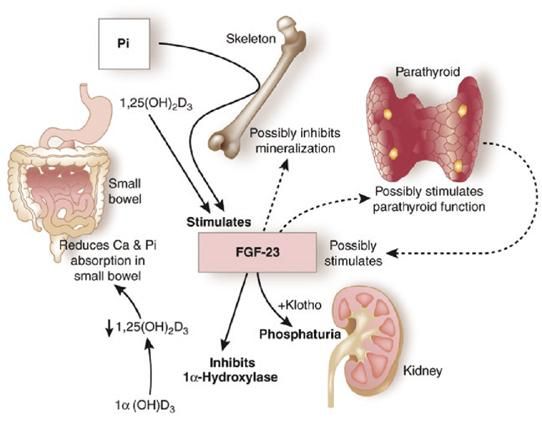
Azioni fisiologiche di FGF23 a livello renale
Le azioni renali di FGF23 (Klotho-dipendenti) sono ormai note e ben definite, in particolare a livello renale FGF23 ha la stessa azione del PTH sul riassorbimento tubulare (blocco del cotrasportatore sodio-fosforo IIa e IIc con conseguente effetto fosfaturico) e azione opposta al PTH sull’attivazione della vitamina D (inibizione dell’attività della 1-alfa-idrossilasi renale e up-regolazione dell’attività della 24-idrossilasi con ridotta sintesi della 1,25OHD3 e conseguente riduzione dell’assorbimento intestinale di fosforo attraverso il cotrasportatore sodio-fosforo IIb). FGF23 stimola inoltre il riassorbimento di calcio e sodio nel tubulo contorto distale attraverso la up-regulation rispettivamente del canale del calcio (TRPV5) e del co-trasportatore sodio/cloro (NCC) e inibisce la secrezione di eritropoietina (4).
Alfa–Klotho è considerato un gene anti-invecchiamento (induce resistenza allo stress ossidativo nelle cellule vascolari endoteliali, nelle FMN della parete vasale e nelle cellule di polmone, fegato e cervello) e anti-cancro (inibisce il signaling di insulina/IGF-I e di Wnt-betacatenina), è espresso a livello di diverse cellule dell’organismo (cellule del tubulo renale, cellule paratiroidee, cellule del plesso coroideo) ed è un promotore/corecettore di membrana per l’interazione fra FGF23 e il suo recettore (4).
La Tabella 2 riporta i fattori che influenzano il riassorbimento di fosforo a livello del tubulo contorto prossimale. La Figura 1 descrive le azioni fisiologiche di FGF23 a livello renale.
Tabella 2. Fattori che influenzano il riassorbimento di fosforo a livello del tubulo contorto prossimale
| Fattori che riducono il riassorbimento |
|
| Fattori che aumentano il riassorbimento |
|
Implicazioni fisiopatologiche di FGF23 nella malattia renale cronica
Meno note sono le implicazioni fisiopatologiche di FGF23 nella malattia renale cronica: con il progressivo deterioramento della funzione glomerulare, alla ritenzione di fosforo corrisponde un aumento consensuale di FGF23 da parte dell’osso; già per valori di eGFR compresi tra 60 e 90 ml/min iniziano ad aumentare i livelli plasmatici di FGF23 (rialzo molto precoce con valori fino a 1000 volte nella malattia renale cronica avanzata) mentre la fosforemia, che rimane entro il range di normalità negli stadi iniziali della insufficienza renale, inizia ad aumentare in modo significativo solo per valori di eGFR <30 ml/min. Nella insufficienza renale cronica si rendono evidenti le azioni extra-renali di FGF23, che possono essere Klotho-dipendenti e/o Klotho indipendenti (azione recettoriale di FGF23 che non richiede la presenza del co-recettore di membrana) (5).
Gli effetti Klotho-indipendenti di FGF23 nella malattia renale cronica si esplicano a livello dei seguenti organi:
- cuore, con ipertrofia dei miociti del ventricolo sinistro, in particolare FGF23 e angiotensina II stimolano un cross-talk pro-ipertrofico e pro-fibrotico tra miociti e fibroblasti del tessuto muscolare cardiaco;
- fegato, con aumento della sintesi di citochine pro-infiammatorie (5).
Gli effetti Klotho-dipendenti e indipendenti di FGF23 nella malattia renale cronica si esplicano invece a livello dei seguenti organi:
- sistema nervoso centrale, con deterioramento cognitivo, in particolare FGF23 determina un’alterazione della morfologia neuronale e della densità sinaptica a livello cerebrale;
- sistema immunitario, con deterioramento delle difese, in particolare FGF23 determina un’inibizione della 1-alfa-idrossilasi nei monociti/macrofagi e un’inibizione del reclutamento/chemiotassi dei granulociti neutrofili;
- sistema vascolare, con disfunzione endoteliale, aterosclerosi e calcificazioni vascolari, in particolare FGF23 è in grado di modulare in senso negativo il bilancio fra ossido nitrico e radicali liberi dell’ossigeno (5).
Le suddette azioni extra-renali di FGF23, insieme all’iperfosforemia, rendono ragione dell’aumentata mortalità del paziente affetto da malattia renale avanzata, legata all’aumentata incidenza di complicanze metaboliche e cardio-vascolari (5).
L’ormone alfa-Klotho
Da ultimo, è noto che da alfa-klotho di membrana, per clivaggio endoproteolitico del dominio extra-cellulare, si forma alfa-Klotho solubile circolante, che può essere a sua volta considerato un vero e proprio ormone con azione beta-glicosidasica, il cui recettore è rappresentato verosimilmente da monosialogangliosidi di membrana e il cui effetto biologico è rappresentato da una complessa e fine regolazione di canali/trasportatori ionici di membrana.
In relazione alla omeostasi del fosforo, alfa-Klotho solubile circolante determina, al pari di FGF23, un’inibizione del co-trasportatore sodio-fosforo IIa quindi ha un effetto fosfaturico che è FGF23 e PTH-indipendente. Alfa-Klotho solubile circolante esplica inoltre un effetto di cardio-protezione, mediato dalla down-regulation del canale cardiaco del calcio (TRPC6) che a sua volta media la genesi dell’ipertrofia cardiaca. Nella malattia renale cronica, già per valori di eGFR inferiori a 90 ml/min, si assiste a un progressivo decremento di alfa-Klotho circolante e il deficit di alfa-Klotho rappresenta in questo setting di pazienti un fattore di rischio per mortalità cardio-vascolare, indipendente dalla iperfosforemia e dagli elevati valori di FGF23 (6).
Bibliografia
- Burton DR. Hormonal regulation of calcium and phosphate balance. In “Uptodate.com” 2018.
- Lieben L, Carmeliet G, Masuyama R. Calcemic actions of vitamin D: effects on the intestine, kidney and bone. Best Pract Res Clin Endocrinol Metab. 2011;25(4):561-72.
- Holick MF. Vitamin D deficiency. N Engl J Med. 2007 Jul 19;357(3):266-81.
- Erben RG, Andrukhova O. FGF23-Klotho signaling axis in the kidney. Bone. 2017 Jul;100:62-68.
- Takashi Y, Fukumoto S. FGF23 beyond Phosphotropic Hormone. Trends Endocrinol Metab. 2018 Nov;29(11):755-767.
- Dalton GD, Xie J, An SW, Huang CL. New Insights into the Mechanism of Action of Soluble Klotho. Front Endocrinol (Lausanne). 2017 Nov 17;8:323.
PUBBLICATO CON IL PERMESSO DI AME
